양극에서 나온 리튬이 음극재로 충전되는 방식에는 4가지로 설명할 수 있다.
대표적으로 현재 상용화되어 쓰이고 있는 흑연은 Intercalation(삽입) 방식이다. 흑연층 사이 육각고리 내에 리튬이 저장된다. 차세대 음극재인 실리콘 음극재는 Alloy(합금) 방식이며, 리튬메탈 음극재는 Plating(도금) 방식이라 할 수 있다. 마지막은 Conversion(전환) 방식으로 간단히 알고 지나가면 될 것 같다.
이차전지의 개발 역사를 간단히 이야기하면 본래 초기의 굿이너프 교수가 제안한 이차전지는 양극재로 TiS2, 음극재로는 리튬금속이었다. 뒤이어 위팅햄 교수는 음극과 양극의 전압차를 더 증대시킬 수 있는 양극재로 LCO를 제안하였다. 문제는 음극재인 리튬금속이었는데 거듭된 충방전시 리튬이 수지상(Dendrite)으로 제멋대로 자라서 양극과 음극이 만나게 되면 폭발을 일으킨다. 요시노 박사가 층상 구조안에 리튬을 저장할 수 있는 흑연을 적용시키면서 리튬 이차전지는 결국 상용화된다. 위 3인은 2019년 노벨화학상을 받았다.
흑연에 리튬을 삽입시키는 것을 충전, 탈리시키는 것은 방전인데 오늘날 이차전지는 리튬 원천이 양극재이므로 최초에 충전을 먼저 시킨다. 초창기의 이차전지 모델은 음극재가 리튬메탈이었으므로 방전을 먼저 시키는 원리였다. 양극재에도 리튬이 들어있고 음극재도 리튬이 들어있으면 얼마나 좋겠는가? 하지만 안전성이 확보되지 않으면 상용화가 어렵기 때문에 용량을 포기하고 저용량의 안전한 지금의 이차전지를 쓰게 된 것이다. 이차전지를 설계할 때 기본적으로 양극보다 음극의 용량이 더 커야 안전하다. (리튬이 저장될 곳이 마땅치 않으면 리튬은 아무 데나 쌓일 것이고 이것은 결국 안전성의 문제를 가져온다) 지금까지는 양극 대비 흑연의 용량이 뒷받침되었으나 고용량 양극재가 개발되면서 음극재의 리튬 저장 용량도 증가될 필요가 있다.
Intercalation(삽입)
흑연이 안정한 이유는 쉽게 말해서 흑연 안에는 이미 안정한 빈 공간이 있고 이 안에 크기가 작은 리튬이 저장될 수 있는 것이다. 애초에 부피팽창이 거의 없어서 소재가 깨지지 않고 가역적인 반응에도 형태를 유지할 수 있다. 리튬은 원자기호 3번으로 금속 중에서 가장 크기가 작다. 따라서 흑연의 층상구조 내로 들어갈 수 있다.(나트륨 전지의 경우 나트륨은 흑연의 층상구조 안에 들어갈 수 없어 음극재로 층상길이가 더 높은 하드카본을 적용 중에 있다)
흑연은 6개의 탄소로 이루어진 육각 고리마다 리튬 1개를 저장한다. 달리 말하면 탄소 6개의 질량 12*6 = 72.0g/mol 마다 리튬 1mol을 저장하고 전자 1mol을 생성시키는 것이다.
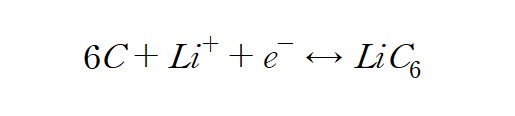
용량(Capacity)의 단위는 mAh/g이다. 어떤 값을 구할 때 단위를 보면 그 값이 어떻게 도출된 것인지 유추할 수 있다. 흑연의 이론용량은 약 372mAh/g 이다.
* 전자 1mol이 가진 전하량 = 1F = 96,485As (패러데이 상수)
패러데이 법칙은 전하량(전류X시간)과 화학량의 정량적인 관계를 나타내는 법칙이다. 물질 11그램 당량을 전기분해로 얻는데 필요한 전하량, 1몰의 전하량을 패러데이 상수라고 한다.

Alloy(합금)
주기율표상 7가지 원소(Al, Si, Ge, Sn, Sb, Pb, Bi)가 리튬과 합금을 형성하나 대표적으로 실리콘이 합금계 음극이다. 실리콘은 질량이 작고 어디에나 존재한다. 이론적으로 22개의 리튬과 5개의 실리콘이 결합한다. 흑연의 경우 탄소 6개가 리튬 1개를 저장한다고 하는데 실리콘 1개가 4.4개의 리튬과 결합한다니 얼마나 용량이 클까? 가장 큰 문제는 리튬이 결합하면서 그만큼 부피가 팽창한다는 것이다. 리튬과 실리콘의 합금은 취성이 약한 이온결합성 물질이다. 따라서 소재가 깨져서 SEI층이 지속적으로 생기고(리튬이 계속 소모됨) 심한 경우 전기적으로 절연이 되는 영역이 생긴다. 초기 용량이 크다 해도 충방전을 거듭할수록 용량손실이 급격해지므로 안정적으로 사용이 어렵다.
100% 실리콘 음극재의 이론용량을 계산해 보면 대략 4200mAh/g 정도 되는데 이는 흑연 이론용량의 10배 이상이다. 실리콘 질량 28.1g/mol이 이론적으로 전자 4.4mol을 생성한다.
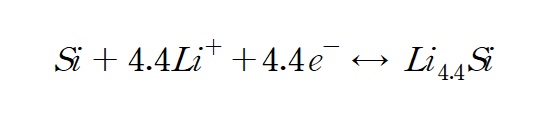

Plating(도금)
리튬메탈 음극재를 생각하면 된다. 리튬이 리튬표면에 도금(축적)되었다가 방전이 표면에서 벗겨져 나온다. 문제는 처음에는 예쁘게 평평하게 존재하던 리튬표면이 그다음 충전 시에 자기 원래 자리를 기억해서 다시 평평하게 도금되느냐 하는 것은 아니다. 마구잡이로 쌓이는데 뾰족한 부분은 점점 더 뾰족해진다. 이러한 현상을 Li-dendrite(수지상, 수지는 나뭇가지 의미함)라고 한다. 이것이 결국 양극과 닿는 순간 순식간에 전자들의 이동으로 단락이 발생해서 화재나 폭발을 일으키게 된다.
Li의 질량은 6.94g/mol이고 리튬의 이론용량은 3800mAh/g 이상이다.


Conversion(전환)
전이금속 산화물(CoO, FeO, NiO, MnO, MnO2) 등이 Conversion 타입인데 Li과 결합 위치를 바꿈으로써 리튬을 저장한다. Conversion Type 역시 Si과 동일한 단점을 가지고 있는데 부피팽창을 동반하며 전기전도도가 낮다. 리튬 반응전위가 흑연이나 실리콘 대비 높으며(양극은 반응전위가 높을수록, 음극은 낮을수록, 양극과 음극의 전위차가 클수록 좋음) 충전 시 생성된 Li2O가 전기전도성이 크게 떨어져 전위가 평탄하지 않으며 충전-방전 곡선 간의 간격(hysteresis)이 크게 나타나 반응이 안정적이지 못하다. 장점 대비 단점이 많아 상용화는 요원해 보인다.
예를 들면 Mn은 2가 금속으로 MnO 1mol은 2mol의 리튬을 저장 및 전자를 생성할 수 있다.
MnO의 질량은 Mn 54.938 + O 15.999 = 70.937 ≒ 70.9g/mol 이다.

